Produktresumé
Aktiv immunisering af heste fra 6 måneders alderen mod equin influenza for at reducere kliniske symptomer og udskillelse af virus efter infektion.
Indtræden af immunitet: 2 uger efter grundvaccination.
Varighed af immunitet: 5 måneder efter grundvaccination.
1 år efter den første revaccination.
Intramuskulær anvendelse.
Lad vaccinen opnå stuetemperatur inden brug.
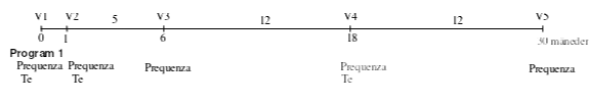
Vaccinationsprogram:
Grundvaccination
En dosis (1 ml) administreres ved intramuskulær injektion efter følgende program:
- Grundvaccination: Første vaccination fra 6 måneders alderen, anden vaccination 4 uger senere.
Revaccination
Det anbefales at man kun administrerer en enkel dosis som booster til heste som allerede har modtaget grundvaccination hvor anvendte vacciner indeholder samme type equin influenzavirus som er inkluderet i denne vaccine. En grundvaccination kan anses for nødvendig i heste som ikke er blevet hensigtsmæssigt grundvaccineret.
Den første revaccination (tredje dosis) gives 5 måneder efter grundvaccinationen. Denne revaccination giver en immunitet mod equin influenza, der varer i mindst 12 måneder.
Anden revaccination gives 12 måneder efter første revaccination.
Vekslende anvendelse, med 12 måneders interval, af en egnet vaccine mod equin influenza indeholdende stammerne A/equine-2/Sydafrika/4/03 og A/equine-2/Newmarket-2/93 anbefales for at opretholde immunitetsniveauet for influenzakomponenten (se skema).
I tilfælde af øget smitterisiko eller utilstrækkelig indtagelse af kolostrum, kan der gives en ekstra vaccination ved 4 måneders alderen efterfulgt af et fuldt grundvaccinationsforløb (vaccination ved 6 måneders alderen og 4 uger senere).
Heste:
Sjælden (1 til 10 dyr ud af 10 000 behandlede dyr): | Hævelse på injektionsstedet1, smerter på injektionsstedet2. |
Meget sjælden (< 1 dyr ud af 10 000 behandlede dyr, herunder enkeltstående indberetninger): | Feber3, sløvhed3, manglende appetit3, overfølsomhedsreaktion4. |
1En diffus hård eller blød hævelse (maks. 5 cm i diameter) forsvinder inden for 2 døgn. En lokal reaktion, som overstiger 5 cm og muligvis vedvarer længere end 2 døgn kan i meget sjældne tilfælde opstå.
2Smerter på injektionsstedet kan resultere i forbigående dysfunktion (stivhed).
3Feber, sommetider ledsaget af sløvhed og manglende appetit, kan forekomme i et døgn og i usædvanlige tilfælde op til 3 døgn.
4Dette omfatter anafylaksi (nogle gange dødelig). Hvis en sådan reaktion forekommer, bør passende behandling straks administreres.
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af markedsføringstilladelsen eller til den nationale kompetente myndighed via det nationale indberetningssystem. Se indlægssedlen for de relevante kontaktoplysninger.
Ingen.
Der foreligger ingen oplysninger om sikkerhed og virkning ved brug af vaccinen sammen med andre lægemidler til dyr. En eventuel beslutning om at anvende vaccinen umiddelbart før eller efter brug af et andet veterinærlægemiddel skal derfor tages med udgangspunkt i det enkelte tilfælde.
Kun raske dyr må vaccineres.