Produktresumé
Aktiv immunisering af heste fra 6 måneders alderen mod equin influenza for at reducere kliniske symptomer og udskillelse af virus efter infektion, samt aktiv immunisering mod tetanus for at forhindre dødelighed.
Influenza
Indtræden af immunitet: 2 uger efter grundvaccination
Varighed af immunitet: 5 måneder efter grundvaccination
1 år efter den første revaccination
Tetanus
Indtræden af immunitet: 2 uger efter grundvaccination
Varighed af immunitet: 17 måneder efter grundvaccination
2 år efter den første revaccination
Intramuskulær anvendelse.
Lad vaccinen opnå stuetemperatur før brug.
Vaccinationsprogram:
Grundvaccination
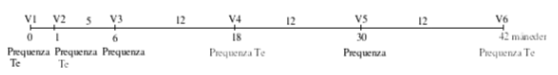
En dosis (1 ml) administreres ved intramuskulær injektion efter følgende program:
- Grundvaccination: Første vaccination fra 6 måneders alderen, anden vaccination 4 uger senere
Revaccination
Influenza
Det anbefales at man kun administrerer en enkel dosis som booster til heste som allerede har modtaget grundvaccination hvor anvendte vacciner indeholder samme type equin influenzavirus som er inkluderet i denne vaccine. En grundvaccination kan anses for nødvendig hos heste som ikke er blevet hensigtsmæssigt grundvaccineret.
Den første revaccination (tredje dosis) mod equin influenza gives 5 måneder efter grundvaccinationen. Denne revaccination giver en immunitet mod equin influenza, der varer i mindst 12 måneder.
Anden revaccination gives 12 måneder efter første revaccination.
Vekslende anvendelse, med 12 måneders interval, af en egnet vaccine mod equin influenza indeholdende stammerne A/equine-2/Sydafrika/4/03 og A/equine- 2/Newmarket-2/93 anbefales for at opretholde immunitetsniveauet for influenzakomponenten (se skema).
Tetanus
Første revaccination gives ikke senere end 17 måneder efter grundvaccinationen.
Derefter anbefales et interval på maks. 2 år (se skema).
I tilfælde af øget smitterisiko eller utilstrækkelig indtagelse af kolostrum, kan der gives en ekstra vaccination ved 4 måneders alderen efterfulgt af et fuldt grundvaccinationsforløb (vaccination ved 6 måneders alderen og 4 uger senere).
Sideløbende aktiv og passiv immunisering (nødvaccination)
Vaccinen kan anvendes sammen med tetanusserum fra Intervet til behandling af tilskadekomne heste, der ikke er blevet immuniseret mod tetanus. I sådanne tilfælde kan første vaccinedosis (V1) gives samtidigt med en behørig profylaktisk dosis af tetanusserum fra Intervet på et andet injektionssted og ved brug af separate sprøjter og kanyler. Den samtidige administration vil give passiv beskyttelse mod tetanus i mindst 21 dage. Den anden vaccinedosis (V2) bør gives 4 uger senere. En tredje vaccination med Equilis Prequenza Te bør gentages mindst 4 uger senere. Samtidig anvendelse af Equilis Prequenza Te og tetanusserum fra Intervet kan reducere den aktive immunitet mod tetanus sammenlignet med heste, der er vaccineret med Equilis Prequenza Te men ikke har fået tetanus antitoksinserum.
Heste:
Sjælden (1 til 10 dyr ud af 10 000 behandlede dyr): | Hævelse på injektionsstedet1, smerter på injektionsstedet2. |
Meget sjælden (< 1 dyr ud af 10 000 behandlede dyr, herunder enkeltstående indberetninger): | Feber3, sløvhed3, manglende appetit3, overfølsomhedsreaktion4. |
1En diffus hård eller blød hævelse (maks. 5 cm i diameter) forsvinder inden for 2 døgn. En lokal reaktion, som overstiger 5 cm og muligvis vedvarer længere end 2 døgn kan i meget sjældne tilfælde opstå.
2Smerter på injektionsstedet kan resultere i forbigående dysfunktion (stivhed).
3Feber, sommetider ledsaget af sløvhed og manglende appetit, kan forekomme i et døgn og i usædvanlige tilfælde op til 3 døgn.
4Dette omfatter anafylaksi (nogle gange dødelig). Hvis en sådan reaktion forekommer, bør passende behandling straks administreres.
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af markedsføringstilladelsen eller til den nationale kompetente myndighed via det nationale indberetningssystem. Se indlægssedlen for de relevante kontaktoplysninger.
Ingen.
Der foreligger oplysninger om sikkerhed og virkning, som viser, at vaccinen kan gives samme dag som, men ikke blandet med tetanusserum fra Intervet (se afsnit 3.9 - Administrationsveje og dosering).
Der foreligger ingen oplysninger om sikkerhed og effekt af vaccinen ved samtidig brug med andre veterinærlægemidler end dem, der er nævnt ovenfor. En eventuel beslutning om at anvende vaccinen umiddelbart før eller efter brug af et andet lægemiddel til dyr skal derfor tages med udgangspunkt i det enkelte tilfælde.
Kun raske dyr må vaccineres.