Produktresumé
Behandling af pruritus i forbindelse med allergisk dermatitis hos hunde.
Behandling af kliniske manifestationer på atopisk dermatitis hos hunde.
Oral anvendelse.
Dosering og behandlingsplan:
Den anbefalede, initiale dosis er 0,4 - 0,6 mg oclacitinib/kg kropsvægt, administreret oralt, to gange dagligt i op til 14 dage.
Ved vedligeholdelsesbehandling bør den samme dosis (0,4 - 0,6 mg/kg kropsvægt) kun administreres én gang dagligt. Nødvendigheden af langtidsbehandling bør baseres på individuel vurdering af fordele og risici.
Tabletterne kan administreres med eller uden foder.
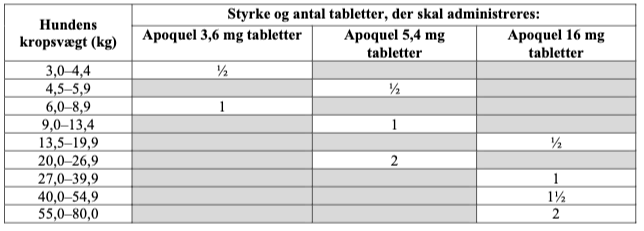
Doseringstabellen nedenfor viser det antal tabletter, der er behov for. Tabletterne kan deles langs med delekærven.
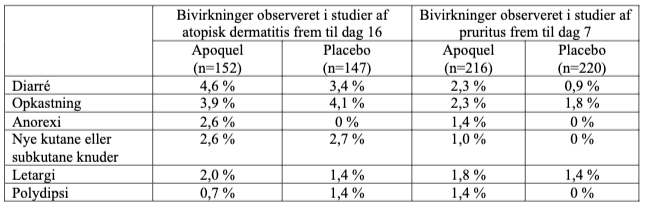
De almindelige bivirkninger, der er set frem til dag 16 i feltstudier, er anført i følgende tabel:
Efter dag 16 er følgende bivirkninger blevet observeret:
- pyoderma og ikke-specificerede dermale knuder er blevet observeret som meget almindeligt
- otitis, opkastning, diarré, histiocytom, cystitis, hudinfektioner med gærsvamp, pododermatitis, lipom, polydipsi, lymfadenopati, kvalme, øget appetit og aggression er blevet observeret som almindeligt.
Behandlingsrelaterede, klinisk patologiske ændringer var begrænset til stigning i gennemsnitlig serumcholesterol og et fald i gennemsnitlig leukocyttal, alle middelværdier forblev dog inden for det laboratoriske referenceområde. Faldet i gennemsnitlig leukocyttal, der blev observeret hos oclacitinibbehandlede hunde, var ikke progressivt og påvirkede tælling af alle hvide blodlegemer (neutrofil-, eosinofil- og monocyttal) undtagen lymfocyttal. Ingen af disse klinisk patologiske ændringer var klinisk signifikante.
I en laboratorieundersøgelse sås udvikling af papillomer hos nogle hunde.
Anæmi og lymfom er meget sjældent rapporteret i spontane rapporter.
For følsomhed over for infektioner og neoplastiske tilstande, se pkt. 4.5 (Særlige forsigtighedsregler vedrørende brugen).
Hyppigheden af bivirkninger er defineret som:
- Meget almindelig (flere end 1 ud af 10 behandlede dyr, der viser bivirkninger i løbet af en behandling)
- Almindelige (flere end 1, men færre end 10 dyr ud af 100 behandlede dyr)
- Ikke almindelige (flere end 1, men færre end 10 dyr ud af 1.000 behandlededyr)
- Sjældne (flere end 1, men færre end 10 dyr ud af 10.000 behandlede dyr)
- Meget sjælden (færre end 1 dyr ud af 10.000 behandlede dyr, herunder isolerede rapporter)
Bør ikke anvendes i tilfælde af overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
Bør ikke anvendes til hunde, der er yngre end 12 måneder eller som vejer mindre end 3 kg.
Bør ikke anvendes til hunde med tegn på immunsuppression, så som hyperadrenocorticisme eller med tegn på progressiv, malign neoplasme, da det aktive stof ikke er undersøgt i disse tilfælde.
Ingen lægemiddelinteraktioner blev observeret i feltstudier, hvor oclacitinib blev administreret samtidig med veterinærlægemidler så som endo- og ektoparasiticider, antimikrobielle lægemidler og antiinflammatoriske lægemidler.
Påvirkningen af oclacitinibadministrationen på vaccination med modificerede, levende vacciner, hundeparvovirus (CPV), hundedistempervirus (CDV) og hundeparainfluenza (CPI) samt inaktiveret rabiesvaccine (RV) hos 16-uger gamle vaccine-naïve hvalpe er blevet undersøgt. Der blev opnået et tilstrækkeligt immunrespons (serologi) over for CDV- og CPV-vaccination, når hvalpe fik oclacitinib 1,8 mg/kg kropsvægt (kv) to gange dagligt i 84 dage. Resultaterne af dette studie indikerer dog en reduktion i serologisk respons over for vaccination med CPI og RV hos hvalpe, der var i behandling med oclacitinib sammenlignet med den ikke-behandlede kontrolgruppe. Den kliniske relevans af de observerede virkninger hos vaccinerede dyr, der samtidig fik administration af oclacitinib (i overensstemmelse med det anbefalede dosisregimen), er uklar.
Ingen.