Produktresumé
Til reduktion af pyreksi i forbindelse med luftvejsinfektion hos kvæg.
Til reduktion af pyreksi i forbindelse med akut mastitis.
Til reduktion af smerte og halthed forbundet med interdigital phlegmone, interdigital
dermatitis og digital dermatitis.
Pour-on anvendelse. Til én applikation. Den anbefalede dosis er 3,33 mg flunixin/kg
kropsvægt (svarende til 1 ml/15 kg kropsvægt). Flasken har et doseringskammer, som er
forsynet med målestreger til angivelse af dosis i forhold til kropsvægt. For at sikre
administration af korrekt dosis skal kropsvægten bestemmes så præcist som muligt.
Påføringsteknikken indøves et par gange for at opnå fortrolighed med håndtering af
flasken, inden dosis påføres dyret.
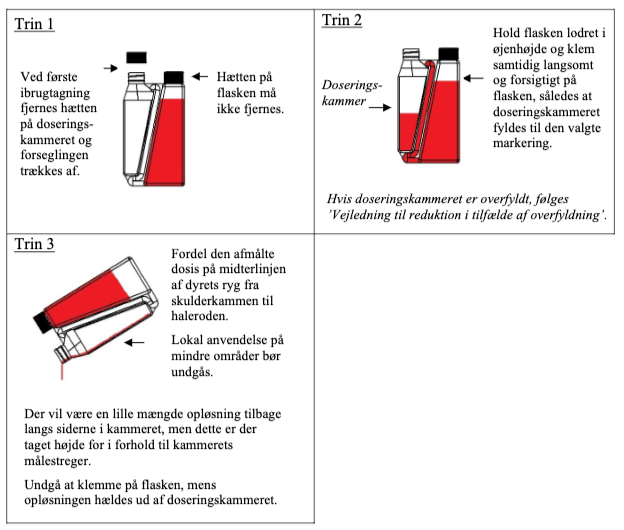
Trin 1: Ved første ibrugtagning fjernes hætten på doseringskammeret og forseglingen trækkes af.
Hætten på flasken må ikke fjernes.
Trin 2: Hold flasken lodret i øjenhøjde og klem samtidig langsomt og forsigtigt på flasken, således
at doseringskammeret fyldes til den valgte markering.
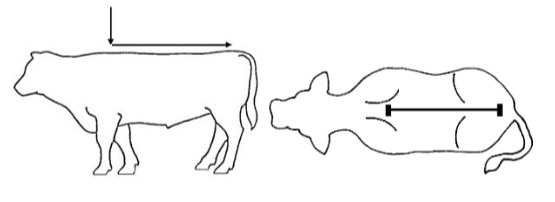
Trin 3: Fordel den afmålte dosis på midterlinjen af dyrets ryg fra skulderkammen til haleroden.
Lokal anvendelse på mindre områder bør undgås.
Vejledning til reduktion i tilfælde af overfyldning
Figur 1 – Anbefalet påføringssted
alopeci eller hudfortykkelse er almindeligt rapporterede reaktioner på applikationsstedet.
Der er normalt ikke behov for specifik behandling.
Nogle dyr kan vise midlertidige tegn på irritation, agitation eller ubehag efter applikation
af lægemidlet. I meget sjældne tilfælde kan der opstå anafylaktiske reaktioner, som kan
være alvorlige, og som bør behandles symptomatisk.
Hyppigheden af bivirkninger er defineret som:
- meget almindelige (flere end 1 ud af 10 dyr får bivirkninger i løbet af en behandling)
- almindelige (flere end 1, men færre end 10 ud af 100 behandlede dyr)
- ikke almindelige (flere end 1, men færre end 10 ud af 1.000 behandlede dyr)
- sjældne (flere end 1, men færre end 10 ud af 10.000 behandlede dyr)
- meget sjældne (færre end 1 ud af 10.000 behandlede dyr, herunder isolerede rapporter).
der er tegn på gastrointestinal ulceration eller blødning.
Må ikke anvendes hos svært dehydrerede, hypovolæmiske dyr, da der er en potentiel risiko
for øget renal toksicitet.
Produktet må ikke anvendes til kvier/køer inden for 48 timer før forventet kælvning.
Bør ikke anvendes i tilfælde af overfølsomhed over for det aktive stof eller over for et eller
flere af hjælpestofferne.
lægemiddel.
Nogle NSAID-præparater kan være meget stærkt bundet til plasmaproteiner og konkurrere
med andre stærkt bundne lægemidler, hvilket kan forårsage toksiske virkninger. Samtidig
administration af potentielt nefrotoksiske lægemidler bør undgås.
efter applikation.
I tilfælde af bakterielle infektioner bør samtidig antibiotikabehandling overvejes.