Produktresumé
Til behandling af flåt- og loppeangreb hos hunde.
Dette veterinærlægemiddel er et systemisk insekticid og acaricid, der har:
- øjeblikkelig og vedvarende dræbende effekt på lopper (Ctenocephalides felis og Ctenocephalides canis) i 12 uger og
- øjeblikkelig og vedvarende dræbende effekt på flåter (Ixodes ricinus, Rhipicephalus sanguineus og Dermacentor reticulatus) i 12 uger.
Lopper og flåter skal sætte sig på værten og starte fødeindtag, før de udsættes for det aktive stof.
Veterinærlægemidlet kan anvendes som del af en behandlingsstrategi til kontrol af loppebetinget allergisk dermatitis (flea allergy dermatitis, FAD).
Til behandling af demodicose forårsaget af Demodex canis.
Til behandling af skab (forårsaget af Sarcoptes scabiei var. canis).
Til spot-on anvendelse.
Veterinærlægemidlet gives i henhold til nedenstående tabel (svarende til en dosis på 25-56 mg fluralaner/kg kropsvægt):
Hundens vægt (kg)
| Styrke og antal pipetter, der skal gives | ||||
Bravecto 112,5 mg | Bravecto 250 mg | Bravecto 500 mg | Bravecto 1000 mg | Bravecto 1400 mg | |
2 - 4,5 | 1 |
|
|
|
|
>4,5 - 10 |
| 1 |
|
|
|
>10 - 20 |
|
| 1 |
|
|
>20 - 40 |
|
|
| 1 |
|
>40 - 56 |
|
|
|
| 1 |
Til hunde, der vejer mere end 56 kg, anvendes to pipetter, hvis styrke tilsammen passer bedst til kropsvægten.
Underdosering kan resultere i ineffektiv brug og kan fremme resistensudvikling.
Indgivelsesmåde
Trin 1: Umiddelbart før brug åbnes brevet og pipetten tages ud. Tag beskyttelseshandsker på. Hold om pipetten i bunden, der hvor den er sammensvejst, eller omkring den hårde del lige under hætten i oprejst stilling (spidsen skal vende opad), når den åbnes. Drej hætten en hel omgang med eller mod uret. Hætten bliver siddende på pipetten; det er ikke muligt at tage den helt af. Pipetten er åben og klar til brug, når man mærker, at forseglingen er brudt. |
|
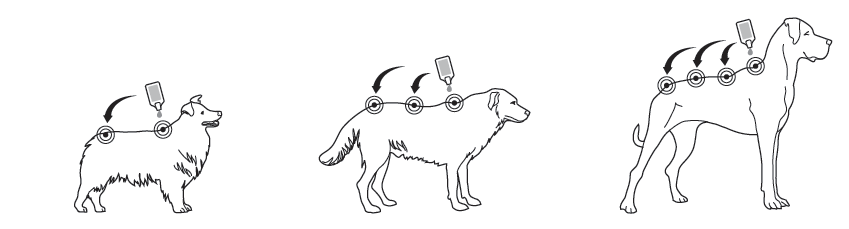
Trin 2: Hunden skal stå eller ligge med ryggen i vandret stilling under påføringen. Placér pipettespidsen lodret på huden mellem hundens skulderblade.
Trin 3: Klem forsigtigt på pipetten og påfør hele indholdet på et eller flere steder (afhængigt af mængden) direkte på hundens hud lang ryggens midterlinje fra skulderbladene til starten af halen. Undgå at påføre mere end 1 ml opløsning på et enkelt applikationssted, idet der ellers er risiko for, at noget af opløsningen vil løbe eller dryppe ned fra hunden.
Behandlingsskema
Behovet for og hyppigheden af genbehandling(er) af loppe- og flåtinfestationer bør ske på baggrund af professionel vurdering og under hensyntagen til lokale risikofaktorer for udvikling af sygdom og dyrets levevis.
For at opnå optimal kontrol af flåt- og loppeangreb skal veterinærlægemidlet gives med 12 ugers mellemrum.
Til behandling af infestationer med miden Demodex canis skal der påføres en enkelt dosis af veterinærlægemidlet. Da demodicose er en multifaktoriel sygdom, anbefales det også at behandle eventuelle underliggende sygdomme på passende måde.
Til behandling af skab (forårsaget af Sarcoptes scabiei var. canis) skal der påføres en enkelt dosis af veterinærlægemidlet. Behovet for og hyppigheden af genbehandling skal fastsættes i overensstemmelse med den ordinerende dyrlæges vurdering.
Hund:
Almindelig (1 til 10 dyr ud af 100 behandlede dyr): | Hudreaktioner på applikationsstedet (såsom erytem, alopeci) #. |
Meget sjælden (< 1 dyr ud af 10 000 behandlede dyr, herunder enkeltstående indberetninger): | Letargi, anoreksi. Opkastning. Muskeltremor, ataksi, kramper. |
# milde og forbigående
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af markedsføringstilladelsen eller til den nationale kompetente myndighed via det nationale indberetningssystem. Se også afsnittet “Kontaktoplysninger” i indlægssedlen.
Må ikke anvendes i tilfælde af overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
Ingen kendte.
Fluralaner har en høj bindingsgrad til plasmaproteiner og kan muligvis konkurrere med andre stærkt bundne aktive stoffer såsom non-steroide anti-inflammatoriske (NSAID) præparater og kumarinderivatet warfarin. Inkubation af fluralaner ved samtidig tilstedeværelse af carprofen eller warfarin i hundeplasma ved forventet maksimal plasmakoncentration reducerede ikke fluralaners, carprofens eller warfarins proteinbinding.
Ved laboratorieundersøgelser og kliniske feltstudier blev der ikke fundet nogen interaktion mellem veterinærlægemidlet og hyppigt anvendte veterinærlægemidler.
Parasitten skal have startet fødeindtag hos værten, før den udsættes for fluralaner; derfor kan risikoen for sygdomme overført fra parasitter ikke udelukkes.
Unødvendig brug af antiparasitære lægemidler eller brug, der afviger fra de givne instruktioner i SPC’et, kan øge selektionstrykket til fordel for resistens og føre til nedsat effekt. Beslutningen om at bruge veterinærlægemidlet bør baseres på bekræftelse af parasit-arten og byrden eller risikoen for infestationer baseret på de epidemiologiske karakteristika for hvert enkelt dyr.
Muligheden for, at andre dyr i samme husstand kan være en kilde til re-infektion med parasitter, bør overvejes, og disse bør behandles efter behov med et passende veterinærlægemiddel.