Produktresumé
Til oral anvendelse.
Administrér dette veterinærlægemiddel på en tom mave (f.eks. om morgenen) og mindst én time før det næste måltid én gang dagligt med en måldosis på 2 mg pr. kg legemsvægt.
Varigheden af behandlingen vil afhænge af responset på behandling. Da feltstudier var begrænset til 28 dage, bør langtidsbehandling overvejes nøje, og dyrlægen bør foretage regelmæssig overvågning.
Da kliniske tegn på osteoarthritis hos hunde er tiltagende-og-aftagende i styrke, kan lejlighedsvis behandling være gavnlig til visse hunde.
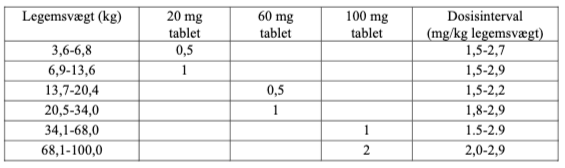
Følgende antal af tabletter skal gives en gang dagligt:
Opkastning var meget almindeligt forekommende i kliniske studier. Blød formet afføring, diarré og manglende appetit var almindeligt forekommende i kliniske studier. Disse tegn var sædvanligvis forbigående.
I meget sjældne tilfælde er der rapporteret forhøjede leverenzymer, forhøjet blodurinstofnitrogen (BUN), forhøjet kreatinin, hæmatemese og hæmoragisk diarré efter markedsføring.
Hyppigheden af bivirkninger er defineret som:
- Meget almindelig (flere end 1 ud af 10 behandlede dyr, der viser bivirkninger)
- Almindelig (flere end 1, men færre end 10 dyr ud af 100 behandlede dyr)
- Ikke almindelig (flere end 1, men færre end 10 dyr ud af 1.000 behandlede dyr)
- Sjælden (flere end 1, men færre end 10 dyr ud af 10.000 behandlede dyr)
- Meget sjælden (færre end 1 dyr ud af 10.000 behandlede dyr, herunder isolerede rapporter).
Bør ikke anvendes i tilfælde af overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne.
Bør ikke anvendes til drægtige eller lakterende dyr eller avlsdyr. Se pkt. 4.7 (Anvendelse under drægtighed, laktation eller æglægning).
Tidligere behandling med andre antiinflammatoriske stoffer kan muligvis medføre yderligere bivirkninger eller en forøget sværhedsgrad af eventuelle bivirkninger. Derfor bør der være en behandlingsfri periode for sådanne veterinærlægemidler før start på behandling med dette veterinærlægemiddel. Den behandlingsfri periode skal tage højde for de farmakokinetiske egenskaber ved de tidligere anvendte præparater.
Samtidig anvendelse af proteinbundne veterinærlægemidler med grapiprant er ikke blevet undersøgt. Almindeligt anvendte proteinbundne veterinærlægemidler omfatter hjerterelaterede, antikonvulsive og adfærdsregulerende lægemidler.
Lægemiddelforenelighed bør overvåges hos dyr, der har brug for supplerende behandling.
Størstedelen af de kliniske tilfælde, der blev vurderet i de kliniske feltstudier, led af let til moderat osteoarthritis baseret på en dyrlægevurdering. For at opnå et underbygget respons på behandling skal veterinærlægemidlet kun anvendes ved lette og moderate tilfælde af osteoarthritis.
I de to kliniske feltstudier var de samlede succesrater baseret på CBPI (Canine Brief Pain Inventory, som blev udfyldt af ejeren) 28 dage efter start på behandlingen 51,3 % (120/235) for Galliprant og 35,5 % (82/231) for placebo-gruppen. Denne forskel til fordel for Galliprant var statistisk signifikant (p-værdi = 0,0008).
Et klinisk respons på behandling ses sædvanligvis inden for 7 dage. Hvis der ikke ses nogen klinisk forbedring efter 14 dage, bør behandling med Galliprant afbrydes, og andre behandlingsmuligheder bør undersøges i samråd med dyrlægen.