Produktresumé
Til forøgelse af kropsvægten hos katte, der lider af ringe appetit og vægttab som følge af kroniske sygdomme (se pkt. 5.1 - Farmakodynamiske egenskaber).
Transdermal anvendelse.
Veterinærlægemidlet påføres topisk på den indvendige side af det ydre øre én gang dagligt i 14 dage med en dosis på 0,1 g salve/kat (2 mg mirtazapin/kat). Det svarer til en streg salve på 3,8 cm (se nedenfor).
Skift hver dag mellem højre og venstre øre. Den indvendige side af kattens øre kan eventuelt rengøres med en tør serviet eller klud umiddelbart før den næste planlagte dosis. Hvis du glemmer at give en dosis, skal du vente til næste dag med at genoptage den daglige dosering.
Den anbefalede faste dosis er testet hos katte med en vægt på mellem 2,1 kg og 7,0 kg.
Sådan påfører du veterinærlægemidlet:
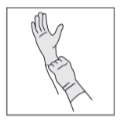
Trin 1:
Tag vandtætte handsker på.
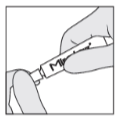
Trin 2:
Drej hætten mod uret for at åbne tuben.
Trin 3:
Tryk jævnt på tuben, så der kommer 3,8 cm salve ud på din pegefinger; brug målestregen på beholderen eller i denne indlægsseddel til at måle.
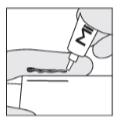
Trin 4:
Brug din finger til forsigtigt at gnubbe salven ind på den indvendige side af kattens ydre øre, idet du fordeler salven jævnt på overfladen. Hvis din hud kommer i kontakt med salven, skal du vaske den med vand og sæbe.
Målestregen nedenfor svarer til den streg salve, der skal påføres:
Reaktioner på påføringsstedet (erytem, skorpedannelse, rester, afskalning/tørhed, flagedannelse, rysten på hovedet, dermatitis eller irritation, hårtab og kløe) og adfærdsændringer (øget vokalisering, hyperaktivitet, desorientering eller ataksi, letargi/svaghed, opmærksomhedssøgende og aggressiv adfærd) var meget almindelige i sikkerhedsstudier og kliniske studier.
Opkastning, polyuri forbundet med reduceret vægtfylde i urin, forhøjet karbamid og dehydrering var almindeligt forekommende i sikkerhedsstudier og kliniske studier. Afhængigt af sværhedsgraden af opkastning, dehydrering eller adfærdsmæssige ændringer kan anvendelsen af produktet seponeres efter dyrlægens vurdering af benefit/risk-forholdet.
Disse bivirkninger, inklusive lokale reaktioner, forsvandt ved slutningen af behandlingsperioden uden specifik behandling.
I sjældne tilfælde kan overfølsomhedsreaktioner forekomme. I disse tilfælde bør behandlingen stoppes øjeblikkeligt.
I tilfælde af oral indtagelse kan der i sjældne tilfælde ses spytdannelse og rysten i tillæg til de førnævnte (ikke lokale) reaktioner.
Hyppigheden af bivirkninger er defineret som:
- Meget almindelige (flere end 1 ud af 10 behandlede dyr, der viser bivirkninger i løbet af en behandling)
- Almindelige (flere end 1, men færre end 10 dyr ud af 100 behandlede dyr)
- Ikke almindelige (flere end 1, men færre end 10 dyr ud af 1.000 behandlede dyr)
- Sjældne (flere end 1, men færre end 10 dyr ud af 10.000 behandlede dyr)
- Meget sjælden (færre end 1 dyr ud af 10.000 behandlede dyr, herunder isolerede rapporter)
Bør ikke anvendes til katte, der skal bruges til avl, er drægtige eller diegivende.
Bør ikke anvendes til dyr, der er under 7,5 måneder gamle, eller som vejer under 2 kg.
Bør ikke anvendes i tilfælde af overfølsomhed overfor det aktive stof eller over for et eller flere af hjælpestofferne.
Bør ikke anvendes til katte, der behandles med cyproheptadin, tramadol eller monoaminoxidasehæmmere (MAOI'er), eller som har været behandlet med en MAOI inden for de seneste 14 dage før behandling med dette veterinærlægemiddel, da der kan være en øget risiko for serotoninsyndrom (se pkt. 4.8 - Interaktion med andre lægemidler og andre former for interaktion).
Bør ikke anvendes til katte, der behandles med cyproheptadin, tramadol eller monoaminoxidasehæmmere (MAOI'er), eller som har været behandlet med en MAOI inden for de seneste 14 dage før behandling med dette veterinærlægemiddel, da der kan være en øget risiko for serotoninsyndrom (se pkt. 4.3 - Kontraindikationer).
Mirtazapin kan øge de sedative egenskaber ved benzodiazepiner og andre stoffer med sedative egenskaber (antihistaminer H1, opiater). Plasmakoncentrationerne af mirtazapin kan også øges ved samtidig anvendelse af ketoconazol eller cimetidin.
Virkningen af veterinærlægemidlet er ikke klarlagt hos katte under 3 år.
Virkningen og sikkerheden ved veterinærlægemidlet er ikke klarlagt hos katte med svær nyresygdom og/eller neoplasi.
Korrekt diagnose og behandling af den underliggende sygdom er vigtig for at behandle vægttab, og behandlingsmulighederne afhænger af sværhedsgraden af vægttabet og den eller de underliggende sygdomme. Behandlingen af en eventuel kronisk sygdom, der er forbundet med vægttab, bør omfatte administration af passende ernæring og overvågning af kropsvægt og appetit.
Behandlingen med mirtazapin bør ikke erstatte nødvendig diagnosticering og/eller behandlingsregimer, som er påkrævet for at behandle den eller de underliggende sygdomme, der forårsager det uønskede vægttab.
Virkningen af lægemidlet blev kun påvist ved 14 dages administration svarende til de aktuelle anbefalinger (se pkt. 4.9 - Dosering og indgivelsesmåde). Gentagelse af behandlingen er ikke undersøgt og bør derfor kun ske efter dyrlægens vurdering af benefit/risk-forholdet.
Virkningen og sikkerheden ved veterinærlægemidlet er ikke klarlagt hos katte, der vejer under 2,1 kg eller over 7,0 kg (se også pkt. 4.9 - Dosering og indgivelsesmåde).