Produktresumé
Til samtidig forebyggelse af kliniske tegn på coccidiose (såsom diarré) hos nyfødte pattegrise i besætninger med tidligere diagnosticeret coccidiose forårsaget af Cystoisospora suis, og forebyggelse af jernmangelanæmi.
Intramuskulær anvendelse.
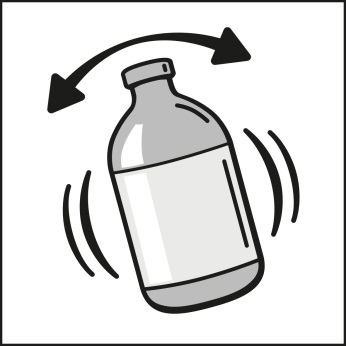
Ryst omhyggeligt før brug, indtil en synlig homogen suspension er opnået og ingen rester sidder fast på (bunden af) hætteglasset.
Veterinærlægemidlet bør administreres til pattegrise mellem 48 til 72 timer efter fødsel med en enkelt intramuskulær injektion på 20 mg toltrazuril pr. kg legemsvægt og 100 mg jern (som gleptoferron kompleks)/kg legemsvægt, hvilket er et dosisvolumen på 0,55 ml/kg legemsvægt.
For at sikre korrekt dosis bør pattegrisenes legemsvægt bestemmes så præcist som muligt.
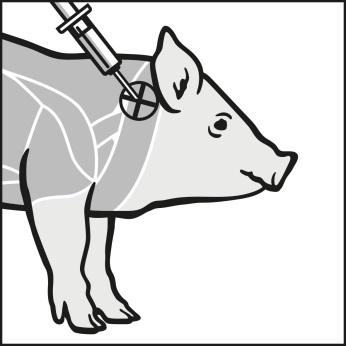
Hver pattegris bør injiceres med en 21 G kanyle. Det foretrukne injektionssted er nakkeområdet (se illustration nedenfor).
1. Ryst hætteglasset omhyggeligt før brug | 2. Træk huden til siden før kanylen indsættes |
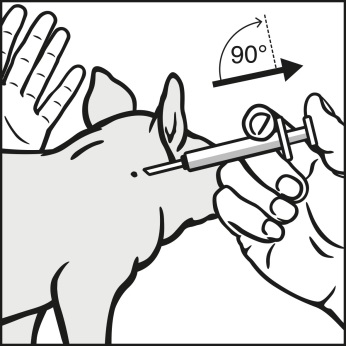
3. Indsæt kanylen i en vinkel på 90º og injicer lægemidlet | 4. Injicér intramuskulært i nakken bag øret |
| |
5. Træk kanylen ud og giv slip på huden |
|
Hætteglassets gummiprop kan sikkert gennembrydes op til 30 gange.
Ved administration af produktet til en flok af dyr, bruges en aftapningskanyle, som placeres i hætteglassets prop, for at undgå overdreven perforering af proppen. Aftapningskanylen skal fjernes efter administration.
Ved administration af produktet til større flokke af dyr anbefales et multi-doseringsaggregat (med ventileret aftapningsapparat). Doseringsenheden på aggregatet bør justeres til pattegrisenes vægt før injektion.
En forbigående misfarvning af vævet og/eller en let hævelse kan almindeligvis observeres ved injektionsstedet. I sjældne tilfælde kan anafylatiske reaktioner forekomme.
I sjældne tilfælde er dødsfald rapporteret blandt pattegrise efter administration af parenterale jern injektioner. Disse dødsfald er blevet associeret med genetiske faktorer eller E-vitaminmangel og/eller selenmangel. Der er rapporteret dødsfald af pattegrise, som skyldtes en øget modtagelighed for infektion grundet midlertidig blokering af det reticuloendotheliale system.
Hyppigheden af bivirkninger er defineret som:
- Meget almindelig (flere end 1 ud af 10 behandlede dyr, der viser bivirkninger i løbet af en behandling)
- Almindelige (flere end 1, men færre end 10 dyr af 100 behandlede dyr)
- Ikke almindelige (flere end 1, men færre end 10 dyr af 1.000 behandlede dyr)
- Sjældne (flere end 1, men færre end 10 dyr ud af 10.000 behandlede dyr)
- Meget sjælden (færre end 1 dyr ud af 10.000 behandlede dyr, herunder isolerede rapporter).
Bør ikke anvendes til pattegrise hvor der mistænkes E-vitaminmangel og/eller selenmangel.
Bør ikke anvendes i tilfælde af overfølsomhed over for de aktive stoffer eller over for et eller flere af hjælpestofferne.
Ingen kendte.
Nyfødte pattegrise kan opleve kliniske tegn svarende til dem som skyldes coccidiose (såsom diarré) af flere årsager (fx andre patogener, stress). Hvis der observeres kliniske tegn i to uger efter administation af produktet, bør den ansvarlige dyrlæge informeres.
Hyppig og gentagen brug af antiprotozo-midler fra samme gruppe kan føre til resistensudvikling.
Det anbefales at administrere produktet til alle pattegrise i et kuld.
Når der er synlige kliniske tegn på coccidiose, er skade på tyndtarmen allerede sket.
Derfor bør produktet administreres til alle dyr før forventet udbrud af kliniske tegn, dvs. i den præpatente periode.
Hygiejniske foranstaltninger kan reducere risikoen for coccidiose. Derfor anbefales det samtidigt at forbedre hygiejnetilstanden på gården, især ved øgning af tørhed og renlighed.
Produktet er ikke anbefalet til pattegrise som vejer mindre end 0,9 kg.