Produktresumé
Symptomatisk behandling af kliniske tegn associeret med Pituitary Pars Intermedia Dysfunction (PPID) (equin Cushings sygdom).
Oral anvendelse, én gang dagligt.
For at lette administrationen kan den ønskede daglige dosis opløses i lidt vand og/eller blandes med melasse eller andet velsmagende foder og omrøres, indtil det er opløst. I dette tilfælde skal de opløste tabletter administreres med en sprøjte. Hele dosen skal administreres med det samme. Tabletterne må ikke knuses.
Startdosis
Startdosis er 2 µg pergolid/kg (dosisinterval: 1,7 til 2,5 µg/kg) kropsvægt. I undersøgelser, der er offentliggjort i litteraturen, anføres det, at den mest almindelige, gennemsnitlige dosis er 2 µg pergolid/kg med et interval fra 0,6-10 µg pergolid/kg. Startdosis (2 µg pergolid/kg, f.eks. én tablet til en kropsvægt på 500 kg) skal herefter titreres i henhold til det individuelle respons, som bestemmes ved monitorering (se nedenfor).
Startdoserne anbefales som følger:
Hestens vægt | Antal tabletter | Startdosis | Doseringsinterval |
200-300 kg | ½ | 0,50 mg | 1,7-2,5 μg/kg |
301-400 kg | ¾ | 0,75 mg | 1,9-2,5 µg/kg |
401-600 kg | 1 | 1,00 mg | 1,7-2,5 µg/kg |
601-850 kg | 1 ½ | 1,50 mg | 1,8-2,5 µg/kg |
851-1000 kg | 2 | 2,00 mg | 2,0-2,4 µg/kg |
Vedligeholdelsesdosis
Der forventes livslang behandling for denne sygdom.
De fleste heste responderer på behandlingen og stabiliseres ved en gennemsnitlig dosis på 2 µg pergolid/kg kropsvægt. Klinisk forbedring ved brug af pergolid forventes inden for 6 til12 uger. Heste kan respondere klinisk ved lavere eller forskellige doser; det anbefales derfor at titrere til den laveste effektive dosis hos det enkelte individ baseret på responsen af behandlingen, hvad enten det er effekt eller tegn på intolerance. Nogle heste kan kræve doser så høje som 10 µg pergolid/kg vægt pr. dag. I disse sjældne situationer tilrådes yderligere passende monitorering.
Efter den indledende diagnosticering gentages de endokrinologiske undersøgelser med henblik på dosistitrering og monitorering af behandlingen med 4-6 ugers mellemrum, indtil de kliniske tegn og/eller resultaterne af de diagnostiske undersøgelser stabiliseres eller forbedres.
Hvis de kliniske tegn eller resultaterne af de diagnostiske undersøgelser ikke er forbedret efter de første 4-6 uger, kan den samlede daglige dosis øges med 0,25-0,50 mg. Hvis de kliniske tegn er forbedret, men endnu ikke normaliseret, kan dyrlægen afgøre, om dosis skal titreres eller ej, afhængigt af individets respons på/tolerance over for dosen.
Hvis de kliniske tegn ikke er tilstrækkeligt kontrolleret (klinisk vurdering og/eller diagnostiske undersøgelser), anbefales det at øge den samlede daglige dosis i trin på 0,25-0,50 mg (hvis lægemidlet tolereres ved denne dosis) hver 4.til 6. uge, indtil der sker en stabilisering. Hvis der udvikles tegn på intolerance over for den aktuelle dosis, skal behandlingen stoppes i 2 til 3 dage og genoptages med det halve af den tidligere dosis. Den samlede daglige dosis kan herefter igen titreres op til den ønskede kliniske effekt i trin på 0,25-0,50 mg hver 2. til 4. uge. Hvis en dosis glemmes, skal den næste planlagte dosis administreres som ordineret.
Efter stabilisering skal der regelmæssigt foretages en klinisk vurdering og diagnostiske undersøgelser hver 6. måned for at monitorere behandling og dosis. Hvis der ikke ses respons på behandlingen, bør diagnosen revurderes.
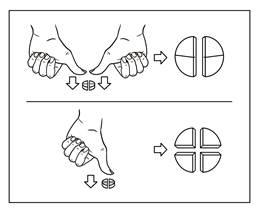
Tabletterne kan deles i 2 eller 4 lige store dele for at sikre en præcis dosering. Placer tabletten på en jævn overflade med delekærven opad og den konvekse side (den rundede side) mod overfladen.
2 lige store dele: Tryk ned på begge sider af tabletten med tommelfingrene.
4 lige store dele: Tryk ned midt på tabletten med tommelfingeren.
Hest:
Sjælden (1 til 10 dyr ud af 10 000 behandlede dyr): | Appetitløshed, anoreksi1, letargi1, påvirkninger af centralnervesystemet2 (f.eks. depression, ataksi), diarré, kolik |
Meget sjælden (< 1 dyr ud af 10 000 behandlede dyr, herunder enkeltstående indberetninger): | Svedtendens |
1 forbigående
2 milde
Indberetning af bivirkninger er vigtigt, da det muliggør løbende sikkerhedsovervågning af et veterinærlægemiddel. Indberetningerne sendes, helst via en dyrlæge, til enten indehaveren af markedsføringstilladelsen eller dennes lokale repræsentant eller til den nationale kompetente myndighed via det nationale indberetningssystem. Se også afsnit 16 i indlægssedlen for de relevante kontaktoplysninger.
Må ikke anvendes i tilfælde af overfølsomhed over for det aktive stof eller andre ergotderivater eller over for et eller flere af hjælpestofferne.
Må ikke anvendes til heste under 2 år.
Anvendes med forsigtighed i tilfælde af at veterinærlægemidlet administreres sammen med andre lægemidler, der er kendt for at påvirke proteinbindingen.
Må ikke administreres sammen med dopamin-antagonister, som f.eks. neuroleptika (phenothiaziner f.eks. acepromazin), domperidon eller metoclopramid, da disse midler kan nedsætte effekten af pergolid.
Der skal udføres relevante endokrinologiske laboratorieundersøgelser samt foretages en vurdering af kliniske tegn for at stille diagnosen PPID.